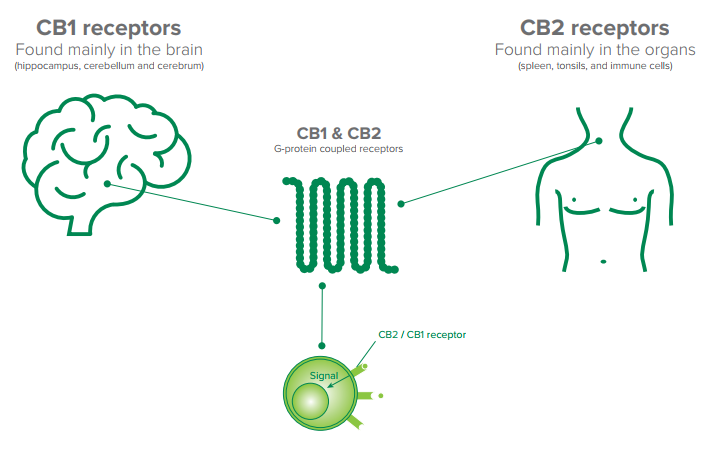
Los receptores cannabinoides CB1 y CB2 forman parte del sistema endocannabinoide endógeno (SCE) que es un sistema de señalización implicado en numerosos procesos como el dolor, el apetito, el movimiento y el cáncer entre otros.
El sistema endocannabinoide -en particular los receptores CB1- es fundamental en la etapa en la que se conforma el cableado del sistema nervioso central, es decir, el momento en que se establecen la conexiones entre neuronas, que a su vez permiten comunicar distintas regiones del cerebro. Los receptores CB1 son especialmente importantes para conectar la corteza con el tálamo. Pero para que esto ocurra de la manera adecuada, por un lado, debe haber suficientes receptores ubicados en una región específica de la neurona y, por otro, las señalizaciones que activan esos receptores deben formarse correctamente.
Receptores CB1
Los receptores CB1 del sistema endocannabinoide son claves para impulsar y guiar el crecimiento de los axones (prolongación de las neuronas, cuyo rol principal es conducir el impulso nervioso desde el cuerpo o núcleo celular hacia otra célula) hasta puntos específicos del cerebro y así poder conectar al tálamo con la corteza cerebral. Para que suceda, es necesario que los receptores CB1 arriben a una región extrema del axón conocida como cono de crecimiento.
Receptores CB2
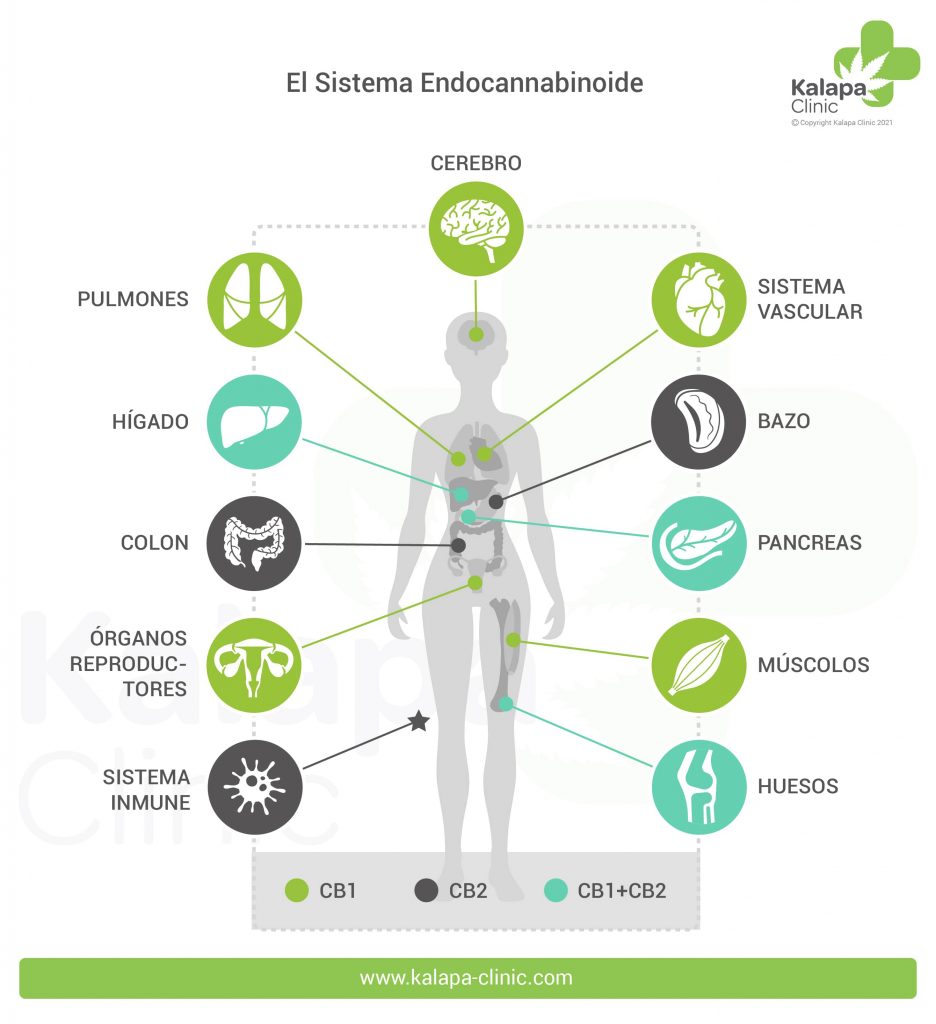
La distribución de los receptores CB-2 es bastante distinta y principalmente restringida a la periferia, en las células del sistema inmunitario como por ejemplo los macrófagos, neutrocilos, monocitos, linfocitos B, linfocitos T y células microgliales. Recientemente se ha demostrado también la presencia del receptor CB-2 en las fibras nerviosas de la piel y en los queratinocitos, en las células óseas como los osteoblastos, los osteocitos y los osteoclastos, en las células hepáticas y en las secretoras de somatostatina del páncreas.
Los receptores cannabinoides (CB), junto con los endocannabinoides, constituyen el sistema endocannabinoide, esencial para que el cuerpo funcione con normalidad. Con millones de años de antigüedad, el sistema endocannabinoide no solo se encuentra en el ser humano, sino también se ha identificado en mamíferos, pájaros, anfibios, y otros animales.
Todos actúan por las mismas vías, a través de los receptores del SEC.
Receptores 5-HT1A
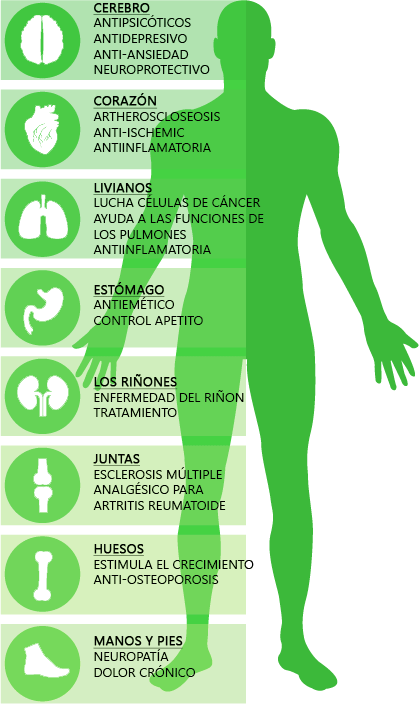
Los 5-HT1A son receptores de Serotonina distribuidos principalmente en estructuras del sistema nervioso central como la corteza cerebral, hipocampo, amígdalas y en niveles más bajos también en los ganglios basales y el tálamo. Estos receptores desencadenan diferentes cascadas intracelulares de mensajes químicos que pueden producir una respuesta tanto excitatória como inhibitoria. En nuestro cuerpo están implicados en procesos como la ansiedad, adicción, apetito, sueño, percepción del dolor, náuseas y vómitos, entre otros. El CBD a dosis elevadas puede activar estos receptores provocando un efecto ansiolítico, antidepresivo y neuroprotector , entre otros.
Receptores del tipo GPR55 y GPR119
Los receptores del tipo GPR se encuentran distribuidos en glándulas adrenales, bazo, sistema digestivo y ampliamente en el SNC: Núcleo Caudado y Putamen, Hipocampo, Tálamo, Hipotálamo, Córtex prefrontal y Cerebelo.
Los GPR podrían representar un puente entre el sistema inmune, el sistema nervioso y el sistema endocrino, por lo que su comprensión arroja terapias a futuro que podrían estar dirigidas al metabolismo lipídico, homeostasis del NA+/K+ u otros iones, así como regular perfiles hormonales. Se ha visto incluso una relación entre ciertos cannabinoides y la intolerancia a glúcidos por lo que se está investigando si estos receptores podrían servir para tratar síndromes relacionados con el metabolismo energético.
Receptor GPR55
Los receptores GPR55 se localizan en regiones del cerebro implicadas en el control de funciones como la memoria, aprendizaje y la coordinación motora, tales como el cuerpo estriado dorsal, núcleo caudado y putamen, así como en varios tejidos periféricos incluyendo íleon, testículos, bazo, amígdalas, mama, tejido adiposo omental, e incluso en algunas líneas de células endoteliales. Debido a su amplia distribución en el SNC se le atribuyen diversas funciones que varían según la localización del receptor:
- Núcleo caudado → Inervado por neuronas Dopaminérgicas / funciones de aprendizaje y memoria / movimiento voluntario.
- Núcleo Putamen → Funciones relacionadas con aprendizaje y movimiento fino / adiadococinesia junto con cerebelo
- Hipocampo → Memoria, en relación a ciertos tipos / memoria espacial y orientación / gestión ansiedad / hiperactividad.
- Tálamo → Filtra todos los estímulos sensitivos menos olfato / conecta con lóbulo frontal, emociones, hiperactividad-depresión / regula actividad visceral.
- Hipotálamo → Regula liberación de hormonas en Hipófisis / conducta alimentaria, ingesta líquidos, apareamiento, agresividad / regulación automática visceral-endocrina.
- Cerebelo → Funciones motoras, adiadococinesia, equilibrio / funciones cognitivas, atención, lenguaje, música.
- Cortex Prefrontal → Personalización del individuo, sentimientos / Conductas apáticas, depresivas, compulsión / procesos de atención.
Receptor GPR119
El receptor GPR119 muestra un patrón de expresión relativamente estrecho encontrándose predominantemente en tejidos pancreáticos e intestinales (26,27,28).
Su localización en las células β de los islotes pancreáticos y las células L intestinales enterócrinas, centra la atención en la posible implicación de los GPR119 en el control de la homeostasis de la glucosa (29) y la obesidad (30).
GPR119 y el tratamiento de la obesidad
Estudios in vitro y con modelos animales han mostrado que su modulación produce efectos beneficiosos en la homeostasis de la glucosa, reduce la ingesta de alimentos (y por lo tanto limita la ganancia de peso corporal) y posiblemente ayuda a preservar las células beta-β productoras de insulina en los islotes pancreáticos (31).
GPR119 y la homeostasis de la glucosa
La expresión de GPR119 en las células β de los islotes pancreáticos ha llevado a la hipótesis de que este receptor podría desempeñar un papel en la modulación de la secreción de insulina. En estudios con animales se ha visto que la estimulación de GPR119 ejerce un doble efecto en la reducción de glucosa en la sangre, actuando directamente sobre la célula β pancreática promoviendo la liberacion de insulina, y de manera indirecta a través de las células enteroendócrinas liberando incretinas como GLP-1 (péptido similar al glucagón) u otros agentes anti-hiperglucémicos.
Bibliografía sobre los receptores cannabinoides
[1] Herkenham M, Lynn AB, Johnson MR, Melvin LS, de Costa BR y Rice KC (1991). Characterization and localization of cannabinoid receptors in the rat brain: A quantitative in vitro autoradiographic study. J Neurosci; 11:563-83.
[2] Katona I, Freund TF. Multiple functions of endocannabinoid signaling in the brain. Annu Rev Neurosci. 2012, 35:529-558
[3] Lu HC, Mackie K. An introduction to the endogenous cannabinoid system. Biol Psychiatry. 2016, 79(7):516-525.
[4] Mechoulam R. Cannabis – the Israeli perspective. J Basic Clin Physiol Pharmacol. 2016, 27(3):181-187.
[5] Macarrone M, Bab I, Biró T, Cabral GA y cols. Endocannabinoid signaling at the periphery: 50 years after THC. Trends Pharmacol Sci. 2015, 36(5):277-296.
[6] Galiègue S, Mary S, Marchand J, Dussossoy D y cols. Expression of central and peripheral cannabinoid receptors in human im- mune tissues and leukocyte subpopulations. Eur J Biochem. 1995, 232(1):54-61.
[7] Benito C, Tolón RM, Pazos MR, Núñez E y cols. Cannabinoid CB2 re- ceptors in human brain inflammation. Br J Pharmacol. 2008, 153(2):277-285.
[8] Di Marzo V, Pisticelli F. The endocannabinoid system and its modulation by phytocannabinoids. Neurotherapeutics. 2015, 12(4):692-698.
[9] Lu HC, Mackie K. An introduction to the endogenous cannabinoid system. Biol Psychiatry. 2016, 79(7):516-525.
[10] Lanciego JL, Barroso-Chinea P, Rico AJ, Conte-Perales L y cols. Expression of the mRNA coding the cannabinoid receptor 2 in the pallidal complex of Macaca fascicularis. J Psychopharmacol. 2011, 25(1):97-104.
[11] Zhang HY, Gao M, Shen H, Bi GH y cols. Expression of functional cannabinoid CB2 receptor in VTA dopamine neurons in rats. Addict Biol. 2016. doi: 10.1111/adb.12367.
[12] Karolinska Institutet, Department of Clinical Neuroscience, Karolinska Hospital, Stockholm, Sweden ( 1999) Localization of 5-HT1A receptors in the living human brain using [carbonyl-11C]WAY-100635: PET with anatomic standardization technique. J Nucl Med. 1999 Jan;40(1):102-9.
[13] Richard A. Glennon, Malgorzata Dukat and Richard B. Westkaemper. Serotonin Receptor Subtypes and Ligands. American College of Neuropsychoparmacology.
[14] Departament de Neuroquimica i Neurofarmacologia, Institut d’Investigacions Biomèdiques de Barcelona (CSIC), IDIBAPS, Barcelona, Spain. Serotonin 1A receptors in human and monkey prefrontal cortex are mainly expressed in pyramidal neurons and in a GABAergic interneuron subpopulation: implications for schizophrenia and its treatment. J Neurochem. 2008 Oct;107(2):488-96. doi: 10.1111/j.1471-4159.2008.05649.x. Epub 2008 Sep 16.
[15] de Mello Schier AR, de Oliveira Ribeiro NP, Coutinho DS, Machado S, Arias-Carrión O, Crippa JA, Zuardi AW, Nardi AE, Silva AC1. Antidepressant-like and anxiolytic-like effects of cannabidiol: a chemical compound of Cannabis sativa. CNS Neurol Disord Drug Targets. 2014;13(6):953-60.
[16] Leonardo BM Resstel,1 Rodrigo F Tavares,1,* Sabrina FS Lisboa,1,* Sâmia RL Joca,2 Fernando MA Corrêa,1 and Francisco S Guimarães1. 5-HT1A receptors are involved in the cannabidiol-induced attenuation of behavioural and cardiovascular responses to acute restraint stress in rats. Br J Pharmacol. 2009 Jan; 156(1): 181–188.
[17] TV Zanelati,* C Biojone,* FA Moreira, FS Guimarães and SRL Joca. Antidepressant-like effects of cannabidiol in mice: possible involvement of 5-HT1A receptors. Br J Pharmacol. 2010 Jan; 159(1): 122–128.
[18] Campos AC1, Guimarães FS. Involvement of 5HT1A receptors in the anxiolytic-like effects of cannabidiol injected into the dorsolateral periaqueductal gray of rats. Psychopharmacology (Berl). 2008 Aug;199(2):223-30. doi: 10.1007/s00213-008-1168-x. Epub 2008 May 1.
[19] Mishima K, Hayakawa K, Abe K, Ikeda T, Egashira N, Iwasaki K, Fujiwara M. Cannabidiol prevents cerebral infarction via a serotonergic 5-hydroxytryptamine1A receptor-dependent mechanism. Stroke. 2005 May;36(5):1077-82. Epub 2005 Apr 21.
[20] Hayakawa K1, Mishima K, Nozako M, Ogata A, Hazekawa M, Liu AX, Fujioka M, Abe K, Hasebe N, Egashira N, Iwasaki K, Fujiwara M. Repeated treatment with cannabidiol but not Delta9-tetrahydrocannabinol has a neuroprotective effect without the development of tolerance. Neuropharmacology. 2007 Mar;52(4):1079-87. Epub 2007 Feb 21.
[21]- Sawzdargo M, Nguyen T, Lee DK, Lynch KR, Cheng R, Heng HH et al. (1999). Identification and cloning of three novel human G protein-coupled receptor genes GPR52, PsiGPR53 and GPR55: GPR55 is extensively expressed in human brain. Brain Res Mol Brain Res 64: 193–198.
[22]- Ryberg E, Larsson N, Sjogren S, Hjorth S, Hermansson NO, Leonova J et al. (2007). The orphan receptor GPR55 is a novel cannabinoid receptor. Br J Pharmacol 152: 1092–1101.
[23]- Marichal-Cancino BA, Fajardo-Valdez A, Ruiz-Contreras AE, Mendez-Diaz M, Prospero-Garcia O. Advances in the physiology of GPR55 in the central nervous system. Curr Neuropharmacol. 2016.
[24]- E Pérez-Gómez, C Andradas, J M Flores, M Quintanilla, J M Paramio, M Guzmán and C SánchezOncogene 32, 2534-2542 (16 May 2013).
[25]- Staton PC, Hatcher JP, Walker DJ, et al. The putative cannabinoid receptor GPR55 plays a role in mechanical hyperalgesia associated with inflammatory and neuropathic pain. Pain. 2008;139(1):225–236.
[26]- Overton HA, Babbs AJ, Doel SM, Fyfe MC, Gardner LS, Griffin G, Jackson HC, Procter MJ, Rasamison CM, Tang-Christensen M, Widdowson PS, Williams GM, Reynet C (Mar 2006). «Deorphanization of a G protein-coupled receptor for oleoylethanolamide and its use in the discovery of small-molecule hypophagic agents». Cell Metabolism. 3 (3): 167–75.
[27] – A role for beta-cell-expressed G protein-coupled receptor 119 in glycemic control by enhancing glucose-dependent insulin release.Chu ZL, Jones RM, He H, Carroll C, Gutierrez V, Lucman A, Moloney M, Gao H, Mondala H, Bagnol D, Unett D, Liang Y, Demarest K, Semple G, Behan DP, Leonard J Endocrinology. 2007 Jun; 148(6):2601-9.
[28]-. Lysophosphatidylcholine enhances glucose-dependent insulin secretion via an orphan G-protein-coupled receptor. Soga T, Ohishi T, Matsui T, Saito T, Matsumoto M, Takasaki J, Matsumoto S, Kamohara M, Hiyama H, Yoshida S, Momose K, Ueda Y, Matsushime H, Kobori M, Furuichi K Biochem Biophys Res Commun. 2005 Jan 28; 326(4):744-51.
[29] -N-Oleoyldopamine Enhances Glucose Homeostasis through the Activation of GPR119. Zhi-Liang Chu Chris Carroll Ruoping Chen Jean Alfonso Veronica GutierrezHongmei He Annette Lucman Charles Xing Kristen Sebring Jinyao Zhou Molecular Endocrinology, Volume 24, Issue 1, 1 January 2010, Pages 161–170.
[30]- Deorphanization of a G protein-coupled receptor for oleoylethanolamide and its use in the discovery of small-molecule hypophagic agents. Overton HA, Babbs AJ, Doel SM, Fyfe MC, Gardner LS, Griffin G, Jackson HC, Procter MJ, Rasamison CM, Tang-Christensen M, Widdowson PS, Williams GM, Reynet C Cell Metab. 2006 Mar; 3(3):167-75.
[31] 24-Li Y, Hansotia T, Yusta B, Ris F, Halban PA, Drucker DJ. Glucagon-like peptide-1 receptor signaling modulates beta cell apoptosis. J Biol Chem. 2003;278:471–478.
[32] Upregulated insulin secretion in insulin-resistant mice: evidence of increased islet GLP1 receptor levels and GPR119-activated GLP1 secretion. Ahlkvist L, Brown K, Ahrén B. Endocr Connect. 2013 Mar 18;2(2):69-78. Print 2013 Jun 1.
[33] Gastric inhibitory polypeptide and glucagon-like peptide-1 in the pathogenesis of type 2 diabetes. Nauck MA, Baller B, Meier JJ. Diabetes. 2004 Dec;53 Suppl 3:S190-6.
[34] Gromada J, Brock B, Schmitz O, Rorsman P(2004). Glucagon-like peptide-1: regulation of insulin secretion and therapeutic potential. Basic Clin Pharmacol Toxicol 95: 252–262.
[35] The Multiple Actions of GLP-1 on the Process of Glucose-Stimulated Insulin Secretion. Patrick E. MacDonald, Wasim El-kholy, Michael J. Riedel, Anne Marie F. Salapatek, Peter E. Light, Michael B. Wheeler. Diabetes 2002 Dec; 51(suppl 3): S434-S442.
[36] Drucker DJ (2006). The biology of incretin hormones. Cell Metab 3: 153–165.
[37] Holst JJ (2006). Glucagon-like peptide-1: from extract to agent. The Claude Bernard Lecture, 2005. Diabetologia 49: 253–260.
[38] VENKATACHALAN, K. Y MONTELL, C. (2007) TRPchannels. Annu. Rev. Biochem. 76: 387-417.
[39] CATERINA, M.J. Y JULIUS, D.D. (2001) The vanilloid receptor: a molecular gateway to the pain pathway. Annu. Rev. Neurosci. 24: 487-517.
[40] Impaired nociception and pain sensation in mice lacking the capsaicin receptor. Caterina MJ, Leffler A, Malmberg AB, Martin WJ, Trafton J, Petersen-Zeitz KR, Koltzenburg M, Basbaum AI, Julius D Science. 2000 Apr 14; 288(5464):306-13.
[41] BELMONTE, C. Y VIANA, F. (2008) Molecular and cellular limits to somatosensory specificity. Mol. Pain. 4: 14.
[42] Cui M, Honore P, Zhong C, Gauvin D, Mikusa J, Hernandez G, Chandran P, Gomtsyan A, Brown B, Bayburt EK, Marsh K, Bianchi B, McDonald H, Niforatos W, Neelands TR, Moreland RB, Decker MW, Lee CH, Sullivan JP, Faltynek CR (2006). «TRPV1 receptors in the CNS play a key role in broad-spectrum analgesia of TRPV1 antagonists». J. Neurosci. 26 (37): 9385–93.
[43] Cellular mechanisms of neurogenic inflammation.Richardson JD, Vasko MR J Pharmacol Exp Ther. 2002 Sep; 302(3):839-45.
[44] The capsaicin receptor: a heat-activated ion channel in the pain pathway. Caterina MJ, Schumacher MA, Tominaga M, Rosen TA, Levine JD, Julius D Nature. 1997 Oct 23; 389(6653):816-24.
[45]- Kym PR, Kort ME, Hutchins CW: Analgesic potential of TRPV1 antagonists. Biochem Pharmacol. 2009, 78: 211-216. 10.1016/j.bcp.2009.02.014
[46] Nilius B, OwsianikG. The transient receptor potential family of ion channels. Genome Biol. 2011;12(3):218.


